اورانیوم یکی از عنصرهای شیمیایی است که عدد اتمی آن ۹۲ و نشانه آن U است و در جدول تناوبی جزو آکتنیدها قرار میگیرد. ایزوتوپ ۲۳۵U اورانیم در نیروگاههای انرژی هستهای به عنوان سوخت و در سلاحهایاتمی به عنوانماده منفجره استفاده میشود.
اورانیم به طور طبیعی فلزی است سخت، سنگین، نقرهای رنگ و پرتوزا. این فلز کمی نرم تر از فولاد بوده و تقریبآ قابل انعطاف است. اورانیم یکی از چگالترین فلزات پرتوزا است که در طبیعت یافت میشود. چگالی آن ۶۵٪ بیشتر ازسرب و کمی کمتر از طلا است.
سالها از اورانیم به عنوان رنگ دهنده لعاب سفال یا برای تهیه رنگهای اولیه در عکاسی استفاده میشد و خاصیتپرتوزایی (رادیواکتیو) آن تا سال ۱۸۶۶ میلادی ناشناخته ماند و قابلیت آن برای استفاده به عنوان منبع انرژی تا اواسط قرن بیستم میلادی مخفی بود.
این عنصر از نظر فراوانی در میان عناصر طبیعی پوسته زمین در رده ۴۸ قراردارد.
اورانیم در طبیعت بصورت اکسید و یا نمکهای مخلوط در مواد معدنی (مانند اورانیت یا کارونیت) یافت میشود. این نوع مواد اغلب از فوران آتشفشانها بوجود میآیند و نسبت وجود آنها در زمین برابر دو در میلیون نسبت به سایر سنگها و مواد کانی است. اورانیم طبیعی شامل ۹۹/۳٪ از ایزوتوپ ۲۳۸U و ۰/۷٪ ۲۳۵U است.
این فلز در بسیاری از قسمتهای دنیا در صخرهها، خاک و حتی اعماق دریا و اقیانوسها وجود دارد. میزان وجود و پراکندگی آن از طلا، نقره یا جیوه بسیار بیشتر است.

در ایران بزرگترین منبع اورانیم مربوط به ساغند اردکانمی باشد.





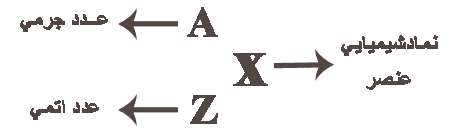
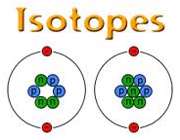

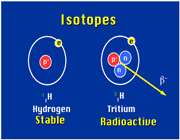
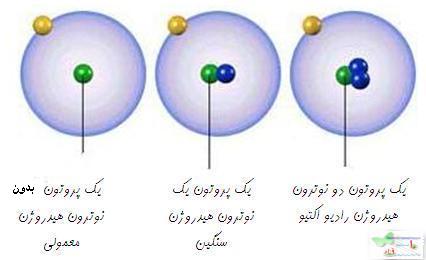
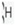 است که 9/99 درصد کل هیدروژن های موجود در طبیعت را شامل می شود. کم تر از 1/0 درصد را
است که 9/99 درصد کل هیدروژن های موجود در طبیعت را شامل می شود. کم تر از 1/0 درصد را 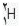 و مقدار ناچیزی را
و مقدار ناچیزی را 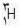 شامل می شود.
شامل می شود.


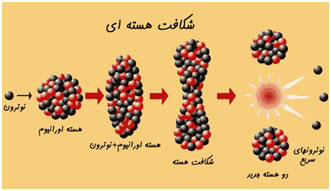
 مولکول به دو یا چند
مولکول به دو یا چند 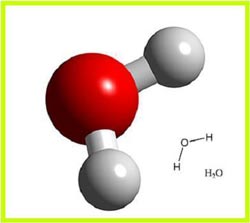
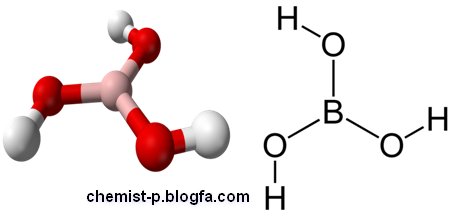
 یک
یک 


 نوترون یکی از
نوترون یکی از 

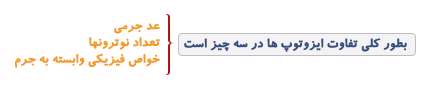
 د اتمی اصطلاحی است که در شیمی و فیزیک مورد استفاده قرار می گیرد. عدد اتمی (به عنوان عدد پروتونی نیز شناخته می شود) تعداد پروتون های موجود در هسته یک اتم است. در نتیجه عدد اتمی با تعداد بارهای هسته یکسان است. عدد اتمی با Z نمایش داده می شود.
د اتمی اصطلاحی است که در شیمی و فیزیک مورد استفاده قرار می گیرد. عدد اتمی (به عنوان عدد پروتونی نیز شناخته می شود) تعداد پروتون های موجود در هسته یک اتم است. در نتیجه عدد اتمی با تعداد بارهای هسته یکسان است. عدد اتمی با Z نمایش داده می شود.