به مجموع تعداد پروتون ها و نوترون های یک اتم عدد جرمی گفته می شود.
تمام اتم های یک عنصر پروتون های یکسان دارند اما تعداد نوترون های آن ها می تواند متفاوت باشد.
عدد جرمی در گوشه بالا و سمت چپ نماد شیمیایی نوشته می شود مثلا اتم کربن در هسته خود 6 پروتون و 6 نوترون دارد پس عدد جرمی آن 12 است. 12C
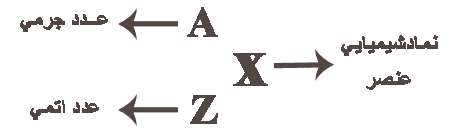
شیمیدان ها برای بیان جرم عنصرها بدین صورت عمل کردند که: فراوان ترین ایزوتوپ کربن یعنی کربن 12 را به عنوان استاندارد انتخاب کردند و جرم عنصرهای دیگر را با استفاده از نسبت هایی که در محاسبات آزمایشگاهی بدست آمده بود، بیان کردند.به عنوان مثال جرم اتم اکسیژن 33/1 برابر جرم اتم کربن است. با توجه به این که جرم اتم کربن 12 می باشد جرم اتم اکسیژن را محاسبه کرد. در این مقیاس جرم اتم اکسیژن برابر 16خواهد شد.واحد جرم اتمی amu است که کوتاه شده ی عبارت atomic mass unitاست. در این مقیاس جرم پروتون و نوترون lamu است.
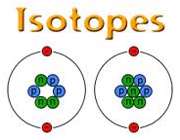
ایزوتوپ
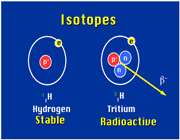
ایزوتوپ ها، اتم های یک عنصر هستند که در تعداد نوترون و در نتیجه عدد جرمی با هم تفاوت دارند اما عدد اتمی آن ها یکسان است.مثلا هیدروژن دارای سه ایزوپ است.

ایزوتوپ های یک عنصر خواص فیزیکی (جرم و چگالی) متفاوت اما خواص شیمیایی یکسان دارند (چون الکترون های آن ها برابر است)بیشتر عناصر، یک ایزوتوپ معمول و چند ایزوتوپ کمیاب دارند به ایزوتوپ های کمیاب تر ناخالصی های ایزوتوپی می گویند.
مثلا ایزوتوپ معمول ئیدروژن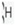 است که 9/99 درصد کل هیدروژن های موجود در طبیعت را شامل می شود. کم تر از 1/0 درصد را
است که 9/99 درصد کل هیدروژن های موجود در طبیعت را شامل می شود. کم تر از 1/0 درصد را 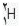 و مقدار ناچیزی را
و مقدار ناچیزی را 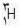 شامل می شود.
شامل می شود.

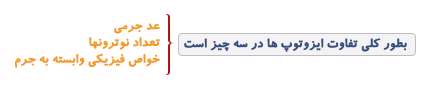
توجه داشته باشید که تعداد نوترون های در هر اتم از رابطه زیر محاسبه می شود.
عدد جرمی (A) تعداد نوکلئونها (پروتون و نوترون) را مشخص میکند و تقریباً برابر با جرم اتم هست اما واحد آنها فرق میکند زیرا جرم اتمی بر واحد گرم بر مول است اما عدد جرمی بر واحد Amuیا واحد کربنی است. برای نشان دادن ساختار هستهای اتم در بالا سمت چپ کنار علامت اختصاری (حروف لاتین) عنصر شیمیایی، عدد جرمی (جمع تعداد پروتون و نوترون) و عدد اتمی (Z تعداد پروتونها) پایین سمت چپ نوشته میشود