خون از سلولهای خونی ومایعی به نام پلاسما تشکیل شده است. نوع گروه خونی توسط شناساگرهای خاصی که بر سطح سلول های خونی وجود دارد مشخص می گردد. این شناساگرها که آنتی ژن نامیده می شوند، به سیستم ایمنی بدن کمک می کنند تا گلبول های قرمز خودی را تشخیص دهد. 4 نوع گروه خونی اصلی وجود دارد که عبارتند از: A/B/AB/O.
مریم شجاعی، کارشناس ارشد بیوشیمی*
خون از سلولهای خونی ومایعی به نام پلاسما تشکیل شده است. نوع گروه خونی توسط شناساگرهای خاصی که بر سطح سلول های خونی وجود دارد مشخص می گردد. این شناساگرها که آنتی ژن نامیده می شوند، به سیستم ایمنی بدن کمک می کنند تا گلبول های قرمز خودی را تشخیص دهد. 4 نوع گروه خونی اصلی وجود دارد که عبارتند از: A/B/AB/O.
این گروه های خونی توسط آنتی ژن هایی که درسطح سلولهای خونی وآنتی بادی هایی که در پلاسمای خونی وجود دارند مدیریت می شوند. آنتی بادی ها که ایمنوگلوبولین نیز نامیده می شوند پروتئین هایی هستند که در برابر عوامل خارجی ترشح می شوند. آنتی بادی ها به آنتی ژن های خاصی که باعث تخریب سیستم ایمنی بدن می شوند متصل می گردند.
برخلاف بقیه شاخص های بدن که توسط 2 الل یا فرم ژنتیکی تعیین می گردد صفت گروه خونی توسط 3 الل کنترل می شود. (A, B, O) این الل های چندگانه 6 نوع ژنوتیپ (ژن هایی که باعث توارث الل ها می گردد) و4 نوع فنوتیپ (بیان کننده صفت های فیزیکی) بروز می دهند.
الل های A و B نسبت به O غالب اند. زمانی که هردو الل به ارث رسیده الل O باشد ژنوتیپ هموزیگوت مغلوب وگروه خونی O است. وقتی که یکی از الل های به ارث رسیده A ودیگری B باشد ژنوتیپ هتروزیگوس و گروخونی AB است.
گروه خونی A:
ژنوتیپ AA یا AO دارند. آنتی ژن های سطح سلول های خونی A وآنتی بادی های پلاسما B می باشد.
گروه خونی B:
ژنوتیپ BB یا BO دارند. آنتی ژن سطح سلول های خونی B و آنتی بادی های پلاسما A است.
گروه خونی AB:
ژنوتیپ AB است. آنتی ژن های سطح سلولهای خونی A وB است وهیچ گونه آنتی بادی درپلاسما وجود ندارد.
گروه خونی O:
ژنوتیپ OO است. هیچ آنتی ژن A یا B درسطح سلول های خونی وجود ندارد و آنتی بادی های A و B در پلاسما دارند.
این واقعیت وجود دارد که افرادی که گروه خونی خاصی دارند در برابر سایر گروه های خونی آنتی بادی تولید می کنند بنابراین گروه خونی افراد برای انتقال باید سازگار باشد.
افرادی که گروه خونیAB دارند به دلیل اینکه در پلاسمای خود هیچ آنتی بادیA یاB ندارند می توانند از افرادی با گروه های خونی A, B, AB یا O خون دریافت کنند.
فاکتور Rh:
علاوه بر آنتی ژن های گروه ABO، یکی دیگر از آنتی ژن گروه خونی واقع در سطوح سلول های قرمز خون فاکتور رزوس یا Rh است. این فاکتور ممکن است در سطح گلبول های قرمز وجود داشته باشد. درصورت وجود این فاکتور گروه خونی مثبت و درغیر این صورت منفی است. افرادی که Rh مثبت اند می توانند از Rh+ و Rh- خون دریافت کنند. افرادی که Rh منفی اند تنها می توانند از Rh- خون دریافت کنند.
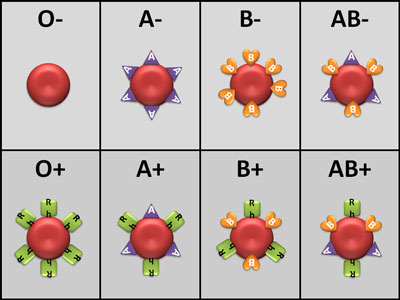
ترکیب گروه های خونی عامل ABO و Rh، در مجموع هشت نوع گروه خونی به وجود می آورد.
A+, A-, B+, B-, AB+, AB-, O+, O-
افرادی که AB + می باشد دریافت کنندگان جهانی نامیده می شود زیرا آنها می توانند هر نوع خون دریافت کنند. افرادی که O- هستند اهدا کنندگان جهانی نامیده می شود زیرا آنها می توانند خون به افراد با هر نوع خون اهدا کنند.
منبع:




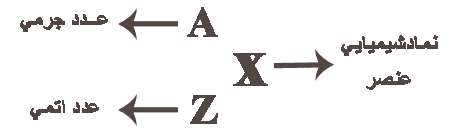
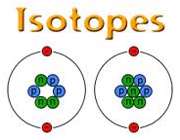

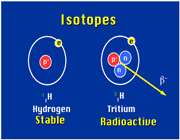
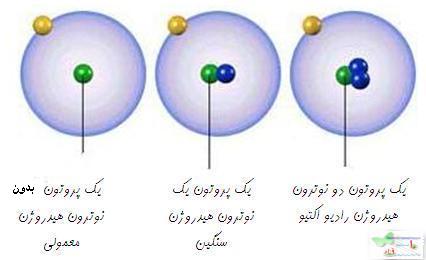
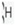 است که 9/99 درصد کل هیدروژن های موجود در طبیعت را شامل می شود. کم تر از 1/0 درصد را
است که 9/99 درصد کل هیدروژن های موجود در طبیعت را شامل می شود. کم تر از 1/0 درصد را 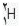 و مقدار ناچیزی را
و مقدار ناچیزی را 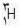 شامل می شود.
شامل می شود.
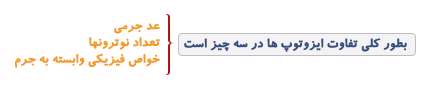


 مولکول به دو یا چند
مولکول به دو یا چند 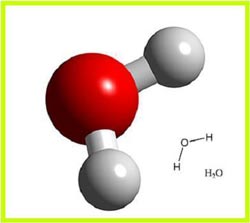
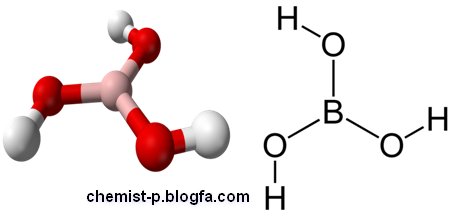
 یک
یک 


 نوترون یکی از
نوترون یکی از 

 د اتمی اصطلاحی است که در شیمی و فیزیک مورد استفاده قرار می گیرد. عدد اتمی (به عنوان عدد پروتونی نیز شناخته می شود) تعداد پروتون های موجود در هسته یک اتم است. در نتیجه عدد اتمی با تعداد بارهای هسته یکسان است. عدد اتمی با Z نمایش داده می شود.
د اتمی اصطلاحی است که در شیمی و فیزیک مورد استفاده قرار می گیرد. عدد اتمی (به عنوان عدد پروتونی نیز شناخته می شود) تعداد پروتون های موجود در هسته یک اتم است. در نتیجه عدد اتمی با تعداد بارهای هسته یکسان است. عدد اتمی با Z نمایش داده می شود.